
今回は原子の構造についてです。「原子の構造なんてもう知ってるよ!」っという方もいると思いますが、放射線は原子の世界の話ですし、いろいろな余計なこともしゃべりますので、再度確認しましょう。
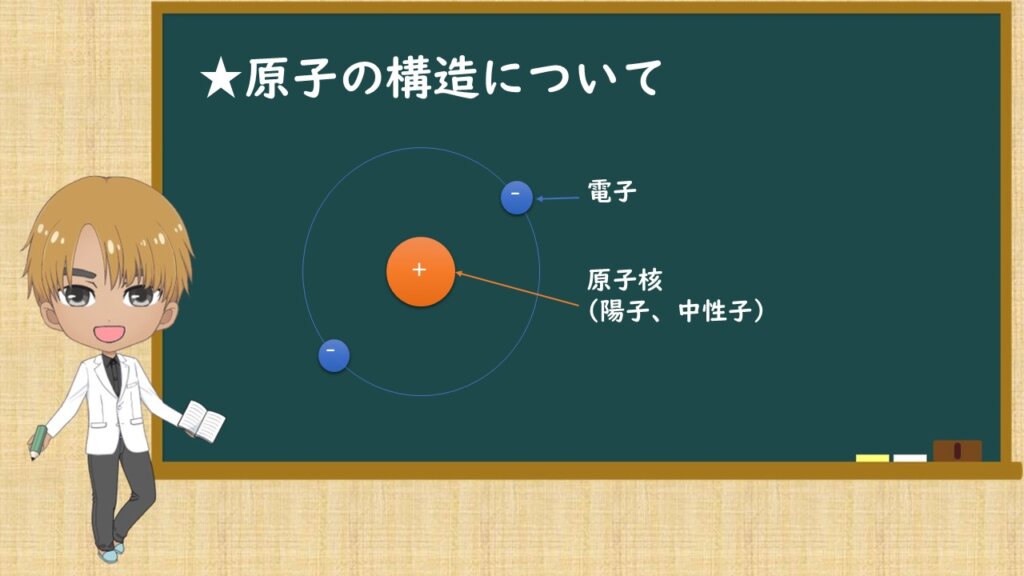
まず、原子の構造と言ったら、真ん中に原子核があり、その周りを電子が回ってるイメージをすると思います。中学校でも高校でもこの図を習うと思います。どうしてこのような模型になったのでしょうか。
ラザフォードの実験というものがあります。ちょっと脱線しますが、説明します。
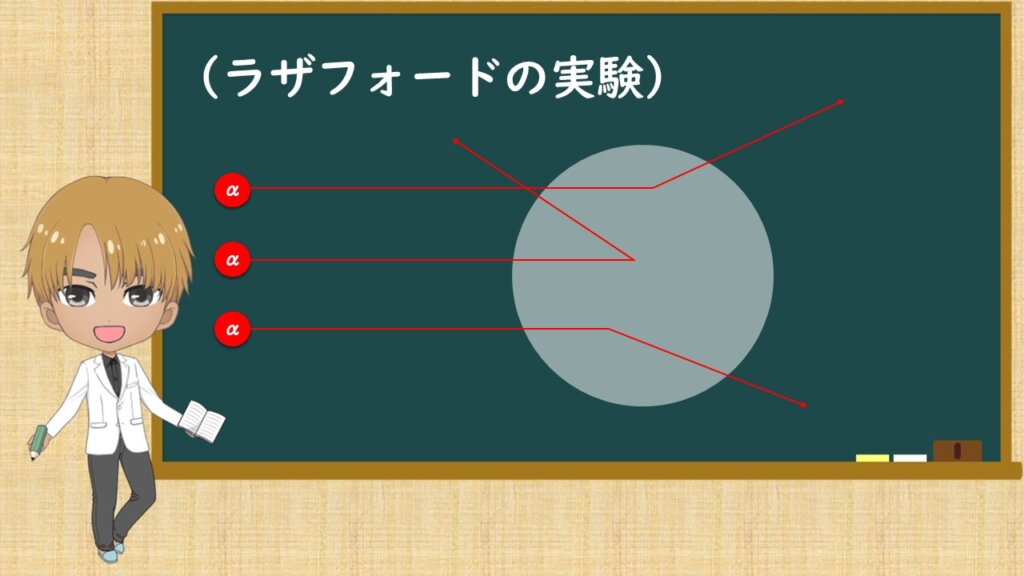
ラザフォードは1911年にα粒子を金の薄箔に衝突させる実験を行いました。その当時、原子の構造なんて知られて無かったが、原子が電子をもっていることはわかっていました。多くの人が原子模型を考えていましたが、実験的な証拠がありませんでした。想像で構造を書いていたような感じですかね。
α粒子は+2の正の電荷をもった粒子です。α粒子を入射させた時、ほとんどのα粒子は角度を変えて散乱して飛んでいきました。しかし、一部のα粒子は後方に散乱されているのがあったのです。
そこから、中心に正の電荷を持つものが有り、そしてそのまわりに電子が存在していると提唱したのです。それがさっきイメージした原子の模型です。
ラザフォードの実験の前に、日本人の長岡半太郎さんという方が真ん中に正の電荷を持つものがあり、その周りに土星の輪のような電子が回っているという模型を提唱していました。しかし、その模型も実験的な証拠が無かったのです。
それを実験的な証拠をもったものがラザフォード模型になります。
令和3年の問題で歴史的な人物や出来事を問う問題が出題されていたので、こーいうのも少し頭に残しておくのも良いと思います。
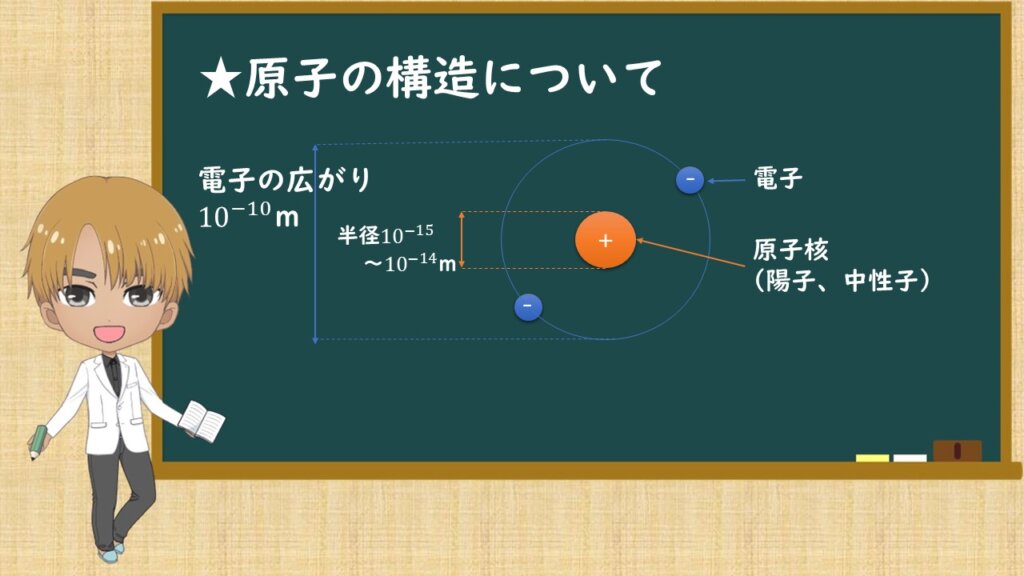
気を取り直して、原子の構造についてです。原子は中心に陽子と中性子からなる原子核、その周りを電子が運動しています。
原子核の半径の大きさは10ー15から10ー14 mと非常に小さく、電子の広がりは10-10 mです。
陽子は正の電荷をもち、電子は負の電荷をもっています。

原子の構造を理解した次は、原子の大きさについてです。
電子の広がりが原子の大きさとなり、その広がりは、原子核と電子の間のクーロン力で決まっています。
原子の大きさは、原子番号が大きくなると電子も増え、k殻、L殻…と軌道が増え、大きくなると考え、「10ー10 mより大きくなるのでは?」と思いませんか。
実は原子の大きさは種類によらずほぼ水素と同じ大きさなのです。天然に存在する元素の中で最も軽い水素と、最も重いウランでも同じ大きさなのです。水素の原子番号は1、ウランの原子番号は92です。
簡単に値を用いて確認してみましょう。
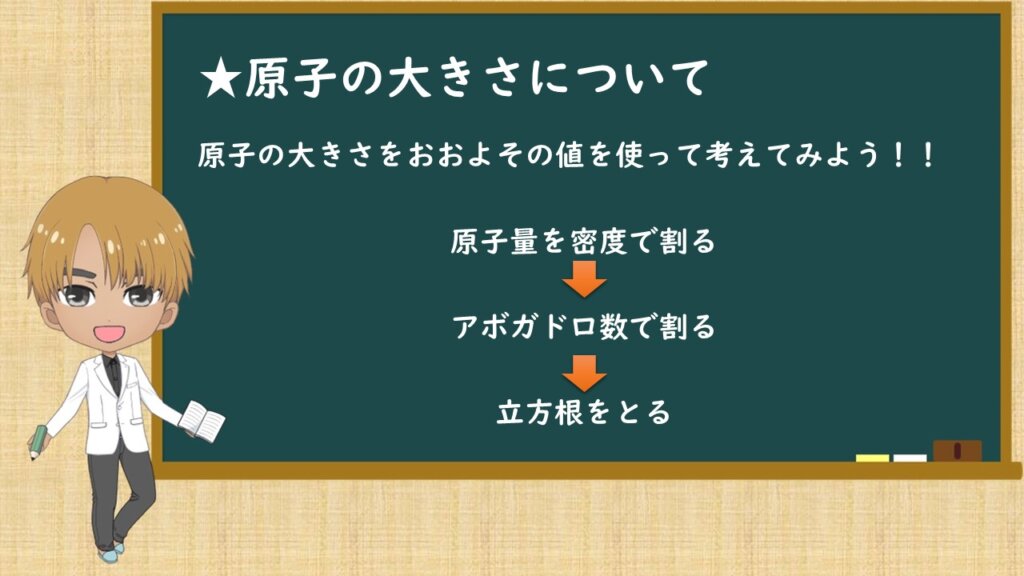
実際に値を用いる前に、どのように計算していくかを説明します。計算の順番は示してあるとおりです。単位を考えると、わかりやすいと思います。
原子量(g/mol)を密度(g/cm3)で割ると、単位はcm3/molになりますね。
その次に、それをアボガドロ数で割ると、cm3/(個)になります。
そして最後に立方根(3乗根)でとると、cm/(個)になります。
原子1個の長さを計算で出せるって事ですね。
※(個)と表記しているのは、個は単位ではないので本来は表記されません。そのためここでは、()をつけて表記しています。この書き方はわかりやすいのでおすすめです。

計算の道筋がわかったところで、実際の値を使って計算してみましょう。
水素の密度と原子量、ウランの密度と原子量はすでにわかっている値です。ネットやアイソトープ手帳などで調べてもらえば既知の値として載っています。
そこから、それぞれさっきの順番で計算し、原子の大きさを出してみると(実際に計算してみてね)、ほぼ同じ、ということがわかります。
以上の事より、原子の大きさは種類によらずほぼ水素と同じ大きさであるとわかったと思います。

今度は原子核について少しやります。のちに原子核の構造についての講義があります。原子核は陽子と中性子から構成されており、陽子、中性子を核子といいます。
陽子数をZ、中性子数をNとすると、質量数はZ+Nになります。
ここで、少し説明しますが、質量数と質量って違いますからね?質量数は今言ったように陽子数と中性子数の合計です。質量は、陽子と中性子の質量は1から少しだけずれています。そのためただ足しても質量数とは少しずれます。また、「原子核の構造」の講義でも言っていますが、陽子と中性子の核力による質量欠損というものもあり、質量数と質量は同じにはなりません。
元素の種類は、陽子の数で決まります。
元素記号を用いると、黒板にあるようになります。

陽子数が同じで中性子数が異なる核種を同位体
中性子数が同じで陽子数が異なる核種を同中性子体
陽子数と中性子数が異なり、同じ質量数を持つ核種を同重体といいます。
それらの関係性を利用して、様々な測定や解析を行っています。
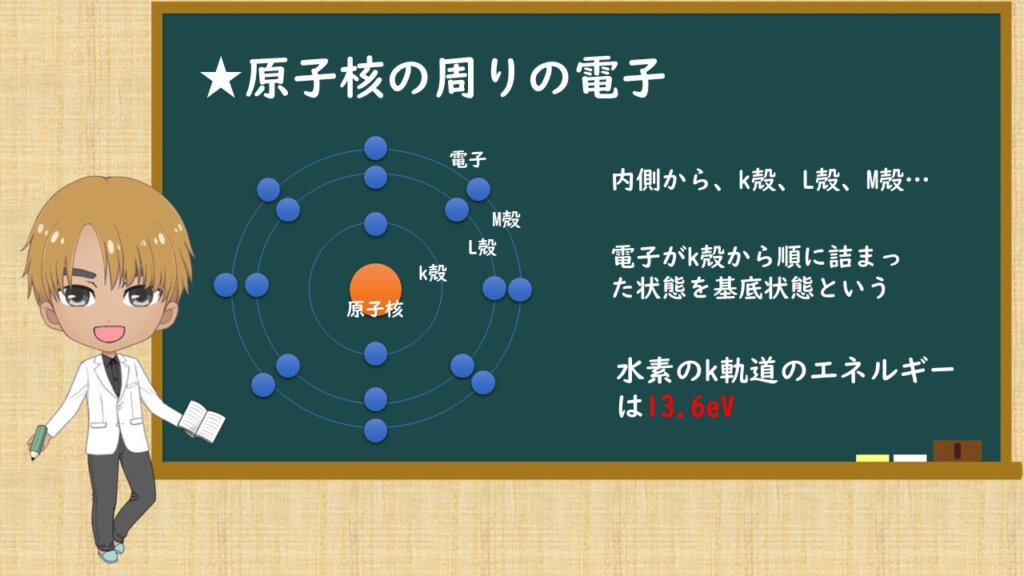
次は、原子核の周りの電子についてです。原子核の周りの電子は軌道電子とも言われます。
一番内側からk殻、L殻、M殻と続いていきます。そして電子はk殻から順に埋まっていき、その状態を基底状態といいます。
軌道電子は原子核とのクーロン力(簡単に言うと、+と-の関係)により束縛されていることより、束縛電子といわれています。束縛の力(束縛エネルギー)は内側の方が原子核に近いことより、内側の方が高いです。
ボーアの条件より、電子の定常状態のエネルギーを求める式がありますが、式を覚える必要は無いと思います。
そのエネルギーを求める式より、水素のk軌道のエネルギーを求めると、13.6eVとなります。この値だけは覚えておくと良いと思います。
軌道電子はどのような動きをするかです。軌道電子は励起と電離という動きをします
軌道電子は、軌道内で決まった値のエネルギーをもって存在しています。電子が円の中をぐるぐる回ってるって考えると、k軌道とL軌道ではL軌道の方が電子のエネルギーが高いことがわかります。
散乱や光子の吸収などで、軌道電子が他からエネルギーを得ると、その軌道の中では収まらなくなります。そうすると、電子は、左図の動きのように、そこの軌道よりも高いエネルギーに転移したり、
右図の動きのように、原子の外へ飛び出したりします。
左の動きを励起と言い、その状態を励起状態と言い、右の動きを電離といいます。
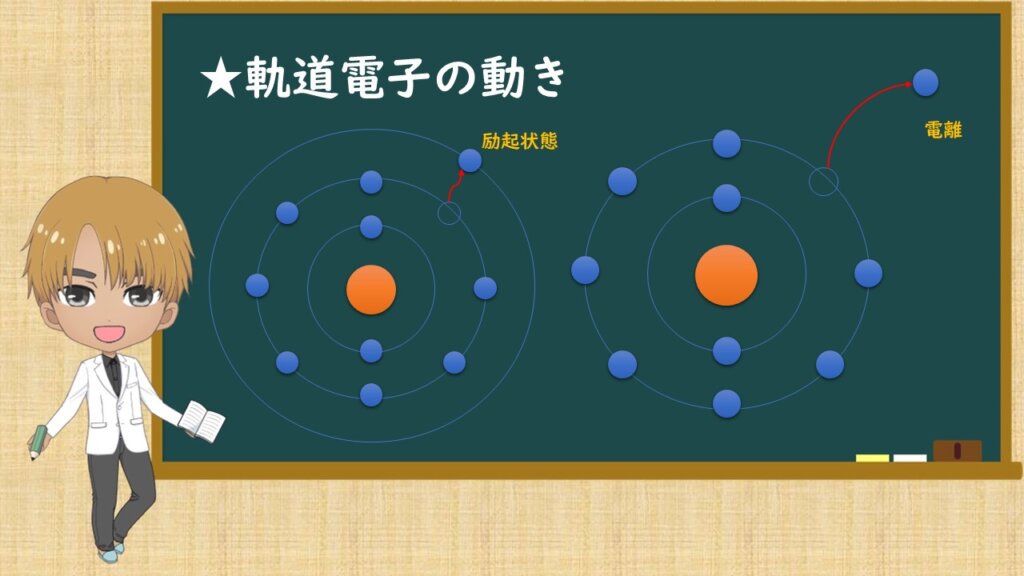
電離、励起が起きた後の軌道を見てみると、電子の空席ができています。この状態は電子は安定状態の基底状態に戻ろうと動きます。
エネルギーの高い軌道の電子が、低いエネルギー軌道に落ちてきて空席を埋めます。そのエネルギーの差分を光子として放出します。それが特性X線またはオージェ電子なのですが、
それについては次のお話になります。
以上で今回の原子の構造については終わりになります。お疲れ様でした。




コメント